- PANCRÉAS
- PANCRÉASComme le foie, auquel l’apparente son origine embryologique (à partir d’ébauches siégeant au niveau de la région antérieure, ou duodénale, de l’intestin moyen), le pancréas est une glande très caractéristique des Vertébrés.La différenciation des cellules endothéliales embryonnaires aboutit à la formation de deux tissus distincts: d’une part, des sacs glandulaires ou acini , communiquant, par des canaux excréteurs, avec le duodénum et l’intestin, représentent le tissu glandulaire exocrine (c’est-à-dire responsable de la sécrétion externe); d’autre part, des éléments glandulaires, groupés en amas clos, ou îlots de Langerhans, dont la sécrétion se déverse dans des capillaires sanguins, ce qui est le fait d’un tissu endocrine (c’est-à-dire responsable d’une sécrétion interne).Ces deux tissus sont parfois anatomiquement séparés, chez certains Vertébrés inférieurs (Lamproie, Téléostéens), mais en général le tissu endocrine est disséminé, en microscopiques nodules, au sein du parenchyme glandulaire exocrine.Cette disposition histologique explique pourquoi les deux fonctions différentes qu’exerce le pancréas dans la vie de nutrition ont été si tardivement individualisées. Certes, Claude Bernard insistait dès 1856 sur le rôle essentiel du suc pancréatique dans la digestion de toutes les catégories chimiques d’aliments: lipides, protides et hydrates de carbone. Mais la fonction, d’une importance vitale, par laquelle le pancréas endocrine maintient constant le taux du glucose sanguin (glycémie) ne fut démontrée qu’à la fin du XIXe siècle (von Mering et Minkowski, 1889), grâce à des méthodes d’expérimentation physiologique déjà techniquement complexes: ablation de la glande (pancréatectomie), ligature de ses canaux excréteurs. Par ces expériences, Minkowski avait réussi à faire grossièrement la part de la fonction exocrine (abolie dans ces deux expériences) et de la fonction endocrine (supprimée dans la première seulement).Ensuite, les progrès de la biochimie ont permis de fractionner et de purifier par chromatographie les protéines pancréatiques, de séparer les composants cellulaires par ultracentrifugation et d’étudier la cinétique du travail glandulaire par l’emploi des marqueurs isotopiques.Finalement, grâce aux progrès des connaissances en physiologie et en médecine, la pathologie du pancréas, si importante mais longtemps méconnue, est dans une très large mesure accessible aujourd’hui à la thérapeutique.1. Pancréas exocrineHistologieHistologiquement, le pancréas exocrine se compose de lobules formés par la juxtaposition d’acini . Ceux-ci sont constitués par une seule couche de cellules glandulaires pyramidales reposant sur une membrane basale. Ces cellules possèdent une base dense basophile; le sommet renferme des granulations protéiques, les grains zymogènes, qui sont excrétés au pôle apical des cellules dans la lumière de l’acinus. Dans cette lumière font saillie des cellules petites et claires, les cellules centroacineuses, qui représentent le premier élément des voies excrétrices. Elles sont caractérisées par la clarté de leur hyaloplasme, pauvre en organites. À ces cellules font suite les voies excrétrices de l’acinus: canaux intercalaires et interlobulaires. Ces canaux cheminent dans les espaces interacineux, où se trouvent les éléments de soutien, les fibroblastes et les éléments de nutrition, capillaires, artérioles et nerfs. Au milieu du tissu exocrine se trouvent les îlots de Langerhans, composés de cellules à granulations différentes, où se situe la sécrétion endocrine de l’organe.Suc pancréatiqueL’aspect du suc pancréatique est variable, selon les conditions de sécrétion. Lorsque le débit est faible, il est épais, et ressemble à de la glycérine; lorsque le débit est élevé, il est fluide, incolore et aqueux. La quantité journalière de la sécrétion chez l’homme est diversement appréciée; elle oscillerait entre 1 000 et 3 000 ml. Le pH est de 8,3 environ. Le suc pancréatique est isotonique au sang. Son poids spécifique est de 1 007.Le suc pancréatique comprend d’une part de l’eau et des électrolytes, d’autre part des composés organiques, essentiellement des protéines, constitués par un mélange complexe d’enzymes.La sécrétion hydro-électrolytiqueLa composition en cations est relativement invariable. Chez l’homme, elle est, pour le sodium, comprise entre 139 et 143 mEq/1 (milliéquivalents par litre) et, pour le potassium, entre 6 et 9 mEq/1. L’ion calcium est plus faiblement représenté à 1,7 梁 0,3 mEq/1. La colonne des anions, bien que totalisant dans toutes les conditions 154 梁 10 mEq/1, est de composition beaucoup plus variable: l’ion bicarbonate est généralement le plus abondant. Sa concentration s’élève lorsque le débit hydrique s’accroît, jusqu’à la limite de 145 mEq/1. L’ion chlore subit les variations inverses; sa concentration s’élève avec des faibles débits.Le mécanisme de la sécrétion hydroélectrolytique reste controversé. Pour les uns (théorie des mélanges; F. Hollander et D. Birnbaum), le suc pancréatique est le résultat du mélange de deux sucs, l’un primaire, contenant le bicarbonate de sodium pratiquement pur, et à une concentration le rendant isotonique au plasma, et l’autre secondaire, obtenu par la diffusion à travers les espaces intercellulaires de chlorure de sodium et peut-être de bicarbonate à la même concentration que dans le plasma (28 mEq/1). Selon cette théorie, les concentrations de chacun des ions dans les deux sucs restent constantes; seuls les débits des sucs varient et, par la suite, le rapport des débits entre eux. Pour d’autres auteurs (D. A. Dreiling et H. D. Janowitz), la sécrétion hydro-électrolytique se réaliserait en deux étapes: une première étape de sécrétion primaire d’un suc composé d’une solution de bicarbonate isotonique au plasma, la seconde étape étant constituée par l’établissement, au cours de la traversée des voies pancréatiques, d’un processus d’échange, à travers l’épithélium des canaux, entre les ions bicarbonate qui sont réabsorbés et les ions chlore qui sont sécrétés dans le suc.Les cellules responsables de la sécrétion hydro-électrolytique seraient classiquement les cellules centro-acineuses et les cellules canaliculaires. Actuellement, toutefois, on pense que les cellules acineuses jouent un rôle dans cette sécrétion.La sécrétion enzymatiqueLe suc pancréatique comprend des enzymes protéolytiques, des enzymes lipolytiques et une enzyme glycolytiqueIl est actuellement établi, grâce aux isotopes radioactifs, que la synthèse des enzymes se fait dans la cellule acineuse qui incorpore, au niveau de ses ribosomes, en moins de trois minutes, les acides aminés constitutifs des protéines enzymatiques. La migration intracellulaire a été particulièrement étudiée par G. E. Palade. Elle se fait en plusieurs étapes: passage des enzymes dans la fraction membranaire des ribosomes, migration dans les cavités du réticulum endoplasmique, migration dans les vacuoles golgiennes, maturation des grains zymogènes. L’excrétion des enzymes dans la lumière est réalisée par l’expulsion des grains zymogènes au pôle apical de la cellule. À côté de cette excrétion granulaire, certains auteurs pensent qu’il pourrait exister une excrétion molécule par molécule, du moins pour certaines enzymes.Enzymes protéolytiquesÀ la distinction initiale entre deux fractions, l’une active d’emblée (l’érepsine) et l’autre devant être activée (le trypsinogène), a fait suite un démembrement progressif des enzymes protéolytiques. On prit l’habitude de distinguer les protéinases (hydrolysant les protéines) et les peptidases (hydrolysant les peptides). Cette classification a dû être abandonnée lorsqu’on s’aperçut que certaines protéinases, comme la trypsine, pouvaient aussi se comporter comme des peptidases. On distingue donc actuellement les endopeptidases, qui rompent les liaisons peptidiques situées à l’intérieur des chaînes peptidiques ou protéiniques, les exopeptidases, qui détachent les acides aminés terminaux, et enfin les nucléases, enzymes hydrolysant les nucléoprotéines.Les endopeptidasesLes endopeptidases scindent les protéines en protéines plus petites ou en polypeptides; on y note essentiellement la présence de trypsine et de chymotrypsine, qui diffèrent par leur spécificité.La trypsine est la forme active du trypsinogène dont l’activation est réalisée par deux voies essentielles. L’entérokinase sécrétée par la muqueuse intestinale en est un des facteurs importants; mais c’est surtout la trypsine elle-même qui, de pH 7 à pH 8, provoque une réaction autocatalytique. L’ion calcium agit sur les deux temps de l’activation. On a extrait de divers tissus des substances protidiques douées d’un pouvoir inhibiteur sur la trypsine. Deux sont particulièrement importantes: l’une est extraite de la parotide de bœuf (inhibiteur de Frey et de Werle), l’autre est extraite du tissu pancréatique lui-même (inhibiteur de Kunitz). La trypsine agit en attaquant les liaisons peptidiques dont le groupement carboxyle fait partie d’un résidu basique, L-arginine ou L-lysine. Le dosage de la trypsine est fondé sur ces propriétés et utilise des substrats synthétiques aussi spécifiques que possible: par exemple, amides ou esters de l’arginyl.La chymotrypsine est sécrétée sous forme d’un précurseur inactif, le chymotrypsinogène. Les méthodes de fractionnement des protéines ont permis de démembrer les précurseurs de l’enzyme active. Chez le bœuf, chez le chien, il existe deux précurseurs, les chymotrypsinogènes A et B. L’activation du chymotrypsinogène est réalisée grâce à la trypsine et probablement à la chymotrypsine elle-même. La chymotrypsine attaque les liaisons où est engagé le carboxyle d’un acide aminé aromatique. Son activité est maximale quand ce dernier est la tyrosine.Les autres endopeptidases sont d’importance moindre: l’élastase et la collagénase agissent respectivement sur les chaînes protéiques des fibres élastiques et des fibres collagènes.Les exopeptidasesLes exopeptidases détachent les acides aminés en bout de chaîne. Les carboxypeptidases sont sécrétées sous forme de procarboxypeptidases inactives. La leucineaminopeptidase hydrolyse la liaison peptidique de la L-leucine lorsqu’elle est placée en position N terminale.Les nucléasesLes nucléases hydrolysent les longues chaînes de polynucléotides. La ribonucléase fragmente l’acide ribonucléique et la désoxyribonucléase, l’acide désoxyribonucléique.Enzymes lipolytiquesLa lipase constitue de loin la principale enzyme lipolytique du suc pancréatique. C’est une enzyme chargée d’hydrolyser les triglycérides d’acides gras à longue chaîne en émulsion dans la lumière intestinale. Les sels biliaires, l’ion calcium et les produits de la réaction sont les principaux activateurs de la lipase. Le dosage de la lipase est maintenant codifié et on utilise le plus souvent un substrat naturel: l’huile d’olive.Les phospholipases ou lécithinases catalysent l’hydrolyse des glycérophosphatides. Enfin, la cholestéroestérase catalyse réversiblement l’estérification du cholestérol.AmylaseL’amylase pancréatique est une glucosidase qui agit sur les liaisons osidiques de l’amidon (N-amylase), de l’amylopectine (isoamylase) et du glycogène. L’amylase pancréatique est absolument identique à l’amylase salivaire, dont elle va compléter l’action. En fait, l’action de l’amylase s’exerce essentiellement sur l’amidon et aboutit à la formation de dextrine. L’activateur de la réaction est essentiellement l’ion chlore.Les différentes techniques de dosage sont fondées soit sur la variation de la viscosité d’un empois d’amidon ou encore sur la dégradation de l’amidon, mesurée par la disparition de la coloration bleue avec l’iode (méthodes amyloclastiques), soit sur l’apparition de substances réductrices (méthodes saccharogéniques).Régulation de la sécrétionLes mécanismes humorauxLa sécrétineLe mécanisme humoral de la sécrétion pancréatique a été démontré en 1902 par W. M. Bayliss et E. H. Starling. Un broyat de muqueuse duodénale acidifiée, injecté dans la veine jugulaire du chien, produit une sécrétion pancréatique abondante. Cela permet de conclure à la présence dans la muqueuse duodénale d’une substance, d’une « hormone » baptisée sécrétine, véhiculée par la circulation générale jusqu’à l’effecteur pancréatique. Les travaux ultérieurs visèrent à obtenir la purification de la sécrétine.C’est surtout à J. E. Jorpes et à V. Mutt que l’on doit les travaux décisifs sur cette purification. Ils en déterminent la structure totale: vingt-sept acides aminés disposés en une seule chaîne. La synthèse de la sécrétine fut réalisée en laboratoire par M. Bodansky et ses collaborateurs: elle représente à l’heure actuelle la plus longue chaîne totalement synthétisée dont l’activité biologique est identique à celle d’une substance naturelle.La sécrétine est produite dans le duodénum, et chez certaines espèces dans le jéjunum aussi. Sa libération est favorisée par l’introduction d’acide dans le duodénum. Mais ce n’est pas le seul facteur: les peptones, les acides aminés et les graisses favorisent également la libération de sécrétine. Sur le pancréas, l’action de la sécrétine est hydrélatique, augmentant essentiellement le volume du suc excrété et la teneur en bicarbonates. Cette action aboutit à une dilution des enzymes. Cependant, si on réalise une perfusion continue de sécrétine, l’augmentation de la dose injectée provoque une augmentation très passagère de l’activité enzymatique, qui semble due à un lessivage des ferments probablement accumulés dans des acini jusque-là inactifs (H. Sarles et coll.).La pancréozymineAlors qu’on essayait d’identifier le mécanisme réflexe nerveux prévu par Mellanby (1925) comme le seul moyen de régulation de l’excrétion enzymatique pendant la digestion, A. A. Harper et C. C. Vass (1941) démontrèrent que le contenu enzymatique du suc pancréatique augmentait même après la section de tout le système nerveux extrinsèque. Ce travail était le prélude immédiat de la découverte de la pancréozymine dans les extraits de muqueuse de l’intestin grêle. On démontrait que l’injection intraveineuse de pancréozymine accroissait le contenu enzymatique du suc pancréatique sans affecter ni son volume ni son contenu de bicarbonate (A. A. Harper et H. S. Raper, 1943).La pancréozymine paraît agir par action directe sur les cellules acineuses et non par l’intermédiaire des rameaux parasympathiques terminaux; l’activité de la pancréozymine n’est d’ailleurs modifiée ni par la section du pneumogastrique ni par l’atropinisation. Il n’a pas été encore possible d’isoler une pancréozymine purifiée.Outre son action ecbolique sur la sécrétion du suc pancréatique, la pancréozymine agit comme cholécystokinétique: elle favorise l’excrétion de la bile vésiculaire.D’autres hormones paraissent actives sur la sécrétion pancréatique, notamment la gastrine (R. A. Gregory et H. J. Tracy) dont l’action, bien que moindre, se rapproche de celle de la pancréozymine. La séquence terminale de ces deux hormones est d’ailleurs identique.Les mécanismes nerveuxLes fibres cholinergiques, surtout présentes dans les nerfs pneumogastriques, fournissent un suc riche en enzymes et entraînent une diminution du nombre des grains zymogènes dans les cellules pancréatiques. Le mécanisme exact de l’action excito-sécrétoire du vague est encore mal précisé. On ne sait s’il s’agit d’une vasodilatation avec augmentation consécutive du débit sanguin ou d’une stimulation cellulaire directe.Les fibres inhibitrices sont beaucoup moins importantes; elles sont contenues dans les splanchniques, accessoirement dans les vagues, et peuvent diminuer la sécrétion en réduisant l’irrigation.La déconnection du pancréas n’a qu’une action modérée sur la sécrétion: la section du splanchnique est sans effet, celle des vagues laisse persister l’action ecbolique du repas, mais de façon très diminuée et définitive.Cette constatation permet de penser qu’il existe, à côté des nerfs extrinsèques, des mécanismes nerveux locaux capables de réactions réflexes autonomes.Pathologie inflammatoireLa pathologie inflammatoire du pancréas se répartit classiquement en deux grands ensembles: les pancréatites aiguës et les pancréatites chroniques. En réalité, il existe des formes de transition, d’après l’évolution; certaines pancréatites chroniques pourraient succéder à des pancréatites aiguës ou évoluer par des poussées aiguës. On peut donc distinguer des pancréatites aiguës, des pancréatites aiguës récidivantes, des pancréatites chroniques et des pancréatites chroniques récurrentes.En fait, la distinction entre ces différents types évolutifs est d’abord d’ordre anatomique.Les pancréatites aiguës peuvent être soit œdémateuses (pancréas tuméfié, turgescent, luisant d’œdème; mésos épaissis, épanchement séreux péritonéal, localisé ou généralisé), soit nécrotico-hémorragiques (associant trois éléments fondamentaux: nécrose du parenchyme glandulaire, massive ou focalisée, suffusions hémorragiques, cystotéatonécrose, traduite par des taches blanc jaunâtre débordant le pancréas et retrouvées aussi sur les mésos et le péritoine), soit encore suppurées par contamination bactérienne d’un foyer de nécrose.Les pancréatites chroniques se caractérisent par l’atrophie du parenchyme, la sclérose évolutive, les calcifications fréquentes mais inconstantes, la possibilité de lésions aiguës, de nécrose en particulier.La physiopathologie comme la séméiologie des lésions inflammatoires du pancréas diffèrent généralement selon qu’il s’agit d’une pancréatite aiguë ou d’une pancréatite chronique et doivent être envisagées séparément.Pancréatites aiguësPhysiopathologieLe schéma pathogénique classique (Doerr) fait jouer un rôle primordial à l’hyperpression à l’intérieur des canaux pancréatiques. Celle-ci serait le fait d’une hypersécrétion glandulaire associée à un obstacle fonctionnel ou anatomique sur la voie excrétrice. Les lésions tissulaires, œdémateuses, qui en résultent provoquent la libération de kinases, elles-mêmes à l’origine de l’activation des enzymes protéolytiques et de l’autodigestion pancréatique.Les théories modernes font intervenir le rôle de perturbations vasculaires locales et de désordres métaboliques intracellulaires. L’hypoxie et l’abaissement du pH intracellulaire qui en résulterait provoqueraient une activation des enzymes et notamment de la trypsine.Conséquences locales et généralesUn foyer de nécrose se constitue et va évoluer pour son propre compte. La dissémination des enzymes, aussi bien par voie lymphatique que par voie sanguine (toxémie enzymatique), explique les localisations éloignées de la maladie. La diffusion des enzymes dans certains secteurs de l’organisme fait apparaître des épanchements pleuraux ou péritonéaux. La libération des substances vaso-actives à partir du foyer de nécrose: histamine à partir de l’histidine, kinines activées par la libération de kallicréine pancréatique, provoque une contraction des muscles lisses, une vasodilatation et une augmentation de la perméabilité capillaire.Le choc que l’on observe dans la pancréatite aiguë trouve ici son mécanisme primordial.ÉtiologieLa lithiase biliaire avec ou sans atteinte fonctionnelle ou organique du sphincter d’Oddi est le facteur étiologique le plus courant (40 p. 100 des cas environ). Les interventions chirurgicales sur l’abdomen viennent ensuite (15 p. 100). Enfin l’éthylisme peut être considéré comme responsable dans 11 p. 100 des cas. Bien souvent, toutefois, la cause de la maladie n’est pas découverte.Séméiologie et diagnosticLa maladie se manifeste avant tout par un syndrome douloureux violent de la moitié supérieure de l’abdomen. Cette douleur s’accompagne de vomissements, parfois d’occlusion et de choc. La fièvre et l’ictère sont plus rares. On peut observer des troubles de la conscience.Le diagnostic est essentiellement fondé sur les résultats des examens biologiques: élévation importante de l’amylasémie, de la lipasémie et de l’amylasurie des vingt-quatre heures, élévation de la glycémie, abaissement de la calcémie dans les formes sévères.Évolution, traitement, pronosticL’évolution des pancréatites aiguës peut être émaillée de complications hémorragiques, de fistules dans les organes du voisinage, surtout de pseudo-kystes du pancréas. Ceux-ci seront soupçonnés devant la perception d’une masse abdominale, le refoulement des viscères ou des vaisseaux du voisinage à l’examen radiologique, la persistance d’une élévation de l’amylasémie et de l’amylasurie.Le traitement médical vise surtout à lutter contre le choc par une réanimation appropriée; à réduire la sécrétion pancréatique grâce au jeûne, à l’aspiration du liquide gastrique stimulant de la sécrétion pancréatique, à l’emploi de substances anticholinergiques; à lutter contre la douleur par des perfusions de novocaïne; à prévenir l’infection par l’antibiothérapie.Par contre, les espoirs mis dans les antienzymes (inhibiteurs de la trypsine) ont été déçus: ces substances, expérimentalement efficaces, ne paraissent avoir en clinique humaine qu’une action discutable.La chirurgie d’urgence est très controversée. Elle s’impose en cas d’incertitude diagnostique, si le traitement médical n’améliore pas le malade. S’il existe une étiologie biliaire, la cholécystectomie et l’exploration des voies biliaires s’imposent.L’exérèse pancréatique en urgence est parfois préconisée. Au stade secondaire, la chirurgie est indiquée contre les complications et notamment le pseudo-kyste. Par la suite, s’il y a lithiase, et s’il n’y a pas eu d’intervention d’urgence, la cholécystectomie s’impose, ainsi que le traitement chirurgical de l’oddite.Malgré les progrès de la réanimation, en dépit de l’amélioration des techniques chirurgicales, la pancréatite aiguë nécrotico-hémorragique reste une affection très grave de pronostic difficile. La mortalité dépasse 60 p. 100. Par contre, la mortalité des pancréatites œdémateuses est très faible.Pancréatites chroniquesIl est classique de distinguer les pancréatites d’amont et les pancréatites parenchymateuses (H. Sarles et M. Mercadier, 1960).Les pancréatites d’amontLes premières sont dues à un obstacle au niveau des conduits excréteurs du pancréas: une oddite avec ou sans lithiase biliaire, une tumeur de la papille ou un petit cancer de la tête du pancréas peuvent, par exemple, gêner la perméabilité du canal de Wirsung et provoquer une pancréatite en amont de l’obstacle. Expérimentalement, la ligature du canal de Wirsung, le reflux bilio-pancréatique ou duodéno-pancréatique provoquent soit une pancréatite par effraction canalaire, soit une atrophie du parenchyme.Chez l’homme, les lésions sont très différentes; les pancréatites d’amont, satellites de l’obstacle, restent localisées et ne sont jamais calcifiantes; elles se stabilisent ou même régressent partiellement après levée chirurgicale de l’obstacle.Les pancréatites parenchymateusesLes pancréatites parenchymateuses représentent la plus grande partie des pancréatites chroniques (80 p. 100). L’étiologie la plus rencontrée est l’éthylisme chronique, avec une répartition géographique très variable. Les pancréatites éthyliques sont répandues en France et aux États-Unis. Elles sont rares en Grande-Bretagne et en Allemagne. Il s’agit, le plus souvent, de pancréatites calcifiantes. La malnutrition protéique est responsable de nombreux cas de pancréatites chroniques observées en Afrique et en Inde.Les tumeurs parathyroïdiennes qui favorisent les précipitations calciques et qui agissent directement sur la cellule acineuse, par l’intermédiaire d’une hypersécrétion d’hormone parathyroïdienne, provoquent de rares cas de pancréatites chroniques. Les autres causes, vasculaires, toxiques, infectieuses, immunologiques, allergiques, sont plus discutables. Enfin, les pancréatites héréditaires ou familiales sont exceptionnelles.Mécanisme de constitution des pancréatites chroniques nutritionnellesExpérimentalement, H. Sarles et ses collaborateurs sont parvenus à réaliser chez le rat, par un régime riche en alcool et normoprotidique, des pancréatites chroniques anatomiquement identiques aux pancréatites humaines nutritionnelles. Ces auteurs suggèrent que les cellules acineuses sécrètent une protéine anormale (albumine) qui précipiterait dans les canaux, réalisant des bouchons muqueux. À ce niveau se situeraient ensuite les calcifications. La stase canalaire, la dilatation des canaux aboutiraient enfin à l’atrophie du parenchyme. Le mode d’action de l’alcool reste toutefois discuté. Il ne paraît pas agir par spasme du sphincter d’Oddi avec libération exagérée de sécrétine, ni par carence protidique relative, mais plutôt par action toxique directe sur la cellule acineuse. Normalement, en effet, l’alcool est transformé en aldéhyde éthylique par l’alcool-deshydrogénase cellulaire.En cas d’excès d’apport, les xanthine-oxydases cellulaires consomment l’énergie et l’oxygène et entrent en compétition avec le métabolisme des nucléo-protéines, comme de véritables antimétabolites pour les cellules élaborant des protéines, ce qui est évidemment le cas du pancréas exocrine.Séméiologie, diagnostic, traitementLa douleur épigastrique, ou, plus rarement, de l’hypocondre droit ou de l’hypocondre gauche, irradiée en arrière, calmée par la position penchée en avant, est, avec l’amaigrissement, le signe le plus constant.L’ictère fugace, de type rétentionnel, ou plus rarement intense, pseudo-cancéreux (par compression ou œdème du canal cholédoque), le diabète, la diarrhée avec stéatorrhée (excrétion exagérée de lipides par défaut de sécrétion lipasique) constituent déjà des complications; il en est de même pour les hémorragies digestives, par compressions de la veine splénique et hypertension portale segmentaire.Le diagnostic est radiologique et biologique. On notera sur les images radiologiques l’existence de compression et de refoulement des organes et vaisseaux du voisinage, le pancréas ne pouvant, en dehors de l’intervention, être opacifié directement. L’examen biologique consiste à recueillir le liquide duodénal par tubage, pour étudier les constituants du suc pancréatique: bicarbonates, enzymes, sous stimulation par la sécrétine et la pancréozymine. Les résultats ont une grande valeur diagnostique.Le traitement est d’abord médical, diététique (suppression de l’alcool et diminution des lipides) et médicamenteux (anticholinergiques, extraits pancréatiques lyophilisés). L’intensité des douleurs oblige parfois à des interventions chirurgicales, soit de dérivation (anastomoses wirsungojéjunales), soit même d’exérèse.Pathologie tumoraleCancerLa pathologie tumorale du pancréas exocrine est dominée par le cancer. 70 p. 100 des cancers du pancréas siègent au niveau de la tête de l’organe et 30 p. 100 au niveau du corps ou de la queue. Histologiquement, la grande majorité sont des adénocarcinomes.Les tumeurs cancéreuses de la tête ont tendance à comprimer et à obstruer le canal cholédoque, qui se dilate en amont. La bile n’a plus la possibilité de gagner le duodénum, et il se constitue un ictère de type rétentionnel. Le caractère foncé de cet ictère, son aggravation inexorable sans rémission, l’absence classique de fièvre et de douleurs, la perception d’une grosse vésicule dilatée en amont de l’obstacle, l’extrême décoloration des selles, où on ne trouve pas de pigments biliaires, l’hypercoloration des urines, le prurit intense, lié au passage dans le sang de sels biliaires en quantité anormalement élevée, constituent les meilleurs signes du cancer de la tête pancréatique.Plus accessoirement, le cancer de la tête peut comprimer le duodénum et entraîner des vomissements, il peut comprimer le canal de Wirsung et provoquer des pancréatites chroniques d’amont. Il s’accompagne toujours d’un amaigrissement intense, parfois de glycosurie, plus rarement de diarrhée avec stéatorrhée. Il peut envahir les ganglions lymphatiques de la région et les organes du voisinage, comme le tractus intestinal, les reins, les glandes surrénales ou le péritoine. Les métastases, c’est-à-dire les transports à distance par voie sanguine, sont fréquentes, notamment au niveau du foie.Le pronostic est très sévère, le diagnostic, difficile, étant généralement fait trop tard, à la période ictérique. La tumeur est alors généralement inextirpable, et le chirurgien doit se contenter de dériver la bile en anastomosant le canal cholédoque et le duodénum.Autres tumeurs du pancréas exocrineLes pseudo-kystes compliquent soit un traumatisme de la loge pancréatique, soit une pancréatite aiguë nécrotique. Ils sont délimités par une paroi fibreuse et non par un épithélium muqueux. Leur volume est variable, pouvant aller de 100 ml à plusieurs litres. Ils se traduisent par des douleurs, des nausées, des vomissements, un amaigrissement, rarement par un ictère, un épanchement pleural, riche en amylase, ou un épanchement péritonéal (ascite). Ils doivent être traités chirurgicalement.Les kystes vrais sont entourés d’un épithélium muqueux. Ils sont rares. Ils peuvent être congénitaux, isolés ou associés à des kystes d’autres organes (foie, reins), ou acquis, comme les kystes hydatiques ou les adénomes kystiques, susceptibles d’évolution maligne.Maladie fibro-kystique du pancréasDécrite par di Sant’Agnese en 1956, la maladie fibro-kystique du pancréas traduit, au niveau de cet organe, une affection familiale qui frappe les jeunes enfants, la mucoviscidose. La lésion fondamentale est un désordre fonctionnel inexpliqué des glandes endocrines de tout le corps. Les modifications histologiques sont localisées aux cellules muqueuses: le mucus est anormalement visqueux. La sueur contient du chlorure de sodium en excès, ce qui constitue le meilleur test diagnostique. Dans le pancréas, on note des concrétions éosinophiles obstruant les canaux et entraînant des petits pseudo-kystes en amont. L’évolution peut se faire vers l’atrophie des cellules acineuses et la fibrose complète de l’organe.Cliniquement, la stéatorrhée est présente dans 90 p. 100 des cas. En fait, la lésion la plus importante sur le plan clinique est bronchique; les bronches sont obstruées par du mucus très visqueux, ce qui entraîne emphysème obstructif et atélectasie. C’est pourquoi l’insuffisance respiratoire est la principale cause de mortalité.2. Pancréas endocrineAnatomieLes îlots de Langerhans, qui constituent le pancréas endocrine, sont dispersés sur l’ensemble du pancréas, mais prédominent dans sa partie caudale. Leur nombre est de l’ordre de 1,5 à 2,5 millions pour un poids global de 1 à 2 g. Leur taille s’échelonne de 50 à 300 猪m de diamètre, et ils contiennent des centaines à des milliers de cellules endocrines. Leur origine embryologique reste discutée entre une large part d’origine endodermique issue du tube digestif et une part plus restreinte d’origine neuroectodermique possible (crêtes neurales) par analogie avec d’autres cellules du système APUD (glomus carotidien, médullosurrénale, cellules thyroïdiennes).Quatre cellules les composent: les cellules B situées surtout au centre des îlots, sécrétant l’insuline, en constituent de 60 à 90 p. 100; les cellules A, plus périphériques, réunissent la plupart des cellules restantes, sécrétant le glucagon; les cellules D, sécrétant la somatostatine, et les cellules F, sécrétant le polypeptide pancréatique, de localisation périphérique, sont en nombre très réduit. Les îlots constituent des agglomérats cellulaires compacts favorisant les échanges intercellulaires. Les artérioles afférentes pénètrent à travers l’îlot jusqu’à sa zone centrale riche en cellules B, d’où se développe l’arborisation capillaire qui revient ensuite vers la surface de l’îlot pour se déverser enfin dans le système veineux portal. Les cellules endocrines ont une taille de 10 à 15 猪m avec un noyau volumineux et la présence de réticulum endoplasmique granuleux et d’un appareil de Golgi. Les granules sécrétoires intracytoplasmiques permettent de distinguer au microscope électronique les différents types cellulaires: aspects de cristaux denses entourés d’un halo clair pour l’insuline des cellules B, aspect central sphérique dense pour le glucagon des cellules A, aspect central sphérique mais moins dense pour les contenus des granules des cellules D et F. L’immunohistochimie permet une distinction encore plus précise grâce à la spécificité des anticorps antihormones. La caractérisation des types cellulaires par l’identification de leur sécrétion monohormonale ou plurihormonale, détectée grâce à l’aspect des granules, à des réactions histochimiques, aux données de l’étude immunohistochimique, revêt une importance diagnostique et pronostique en matière de tumeurs du pancréas endocrine.Hormones pancréatiquesL’insulineHormone protéique d’un poids moléculaire de 5 700 synthétisée par les cellules B des îlots, l’insuline est formée de deux chaînes peptidiques A (de 21 acides aminés) et B (de 30 acides aminés) réunies par deux ponts disulfures. Elle est issue du clivage de la pro-insuline formée au niveau du réticulum endoplasmique des cellules B à partir de la prépro-insuline, elle-même obtenue après transcription ribosomale de son ARN messager. La prépro-insuline, comptant cent dix acides aminés, est codée au niveau du génome humain par un gène unique situé sur le bras court du chromosome 11. Les deux chaînes de l’insuline sont connectées au sein de la pro-insuline par un segment peptidique de trente et un acides aminés, appelé peptide C, et deux dipeptides composés de deux acides aminés basiques, généralement dénommés CA et BC, car ils assurent la jonction entre les chaînes A et C et B et C, respectivement. La conversion de la pro-insuline en insuline s’opère au niveau de l’appareil de Golgi par action enzymatique permettant la séparation du peptide C et des deux dipeptides.La sécrétion insulinique dépend de nombreux agents sécrétagogues et inhibiteurs. Le glucose plasmatique est l’agent stimulant le plus puissant de la sécrétion d’insuline. Les acides aminés, le peptide inhibiteur (GIP), les glucagon-like peptides (GL-P1 et 2), l’acétylcholine sont des agents stimulants à un degré inférieur, alors que l’adrénaline et la galanine ont des effets inhibiteurs.L’insuline est présente dans le plasma sous une forme libre active et sous une forme liée à une protéine inactive, cette dernière forme étant élaborée au niveau hépatique. Un équilibre, régi par les besoins insuliniques nécessaires pour assurer l’homéostasie glycémique, existe entre ces deux formes circulantes, la forme liée jouant un rôle de «réservoir». La demi-vie circulante est brève, de 6 à 10 minutes, le catabolisme de l’insuline s’effectuant principalement au niveau du foie.L’action biologique de l’insuline fait suite à sa fixation sur un récepteur spécifique membranaire présent au niveau des tissus-cibles musculaire, adipeux et hépatique. Le récepteur est composé de deux sous-unités alpha, où s’effectue la liaison de l’insuline, et de deux sous-unités bêta, unies aux précédentes par des ponts disulfures, sièges d’une autophosphorylation tyrosine-spécifique. L’activité kinase du récepteur est accrue, premier pas d’une suite de réactions biochimiques encore mal définies faisant intervenir la phosphorylation de substrats endogènes intracellulaires et/ou l’activation de seconds messagers qui permettent l’action biologique de l’insuline. Son résultat principal est le recrutement de transporteurs membranaires de glucose au niveau musculaire, hépatique et adipeux qui permettent l’entrée intracellulaire du glucose. Ses effets comprennent également une activation de la glycolyse et de la synthèse de glycogène, une inhibition de la néoglucogenèse, une activation de la synthèse protéique et une action antilipolytique. L’insuline joue donc un rôle essentiel dans la régulation du métabolisme du glucose en favorisant sa pénétration intracellulaire dans les tissus-cibles et son utilisation sur les modes oxydatif et non oxydatif, et un rôle important annexe dans les métabolismes lipidique et protidique.Le glucagonSynthétisé et sécrété par les cellules A des îlots, le glucagon est un peptide de vingt-neuf acides aminés, de 3 500 daltons, issu du clivage du proglucagon, lui-même codé par le gène du préproglucagon situé sur le bras long du chromosome 2. Le proglucagon synthétisé dans le réticulum endoplasmique des cellules A, d’un poids moléculaire de 9 000 daltons, donne naissance au glucagon après clivage d’un peptide de trente-deux acides aminés situé à l’extrémité N terminale de la molécule de glucagon, dont l’action est inconnue.La sécrétion du glucagon est modulée par l’insuline qui s’oppose à sa libération et inhibe également la synthèse du proglucagon. Les jonctions intercellulaires étroites au sein de l’îlot paraissent intervenir dans cette régulation par les communications qu’elles autorisent, de même qu’un mécanisme paracrine favorisé par le réseau capillaire original des îlots, orienté du centre vers la périphérie. La somatostatine inhibe également la sécrétion de glucagon.Les agents extrapancréatiques qui régulent la libération du glucagon comprennent d’une part les neurotransmetteurs liés au système nerveux autonome, d’autre part les peptides libérés par le tractus gastro-intestinal lors de la prise alimentaire. Une régulation physiologique complexe module ainsi les sécrétions respectives d’insuline et de glucagon afin d’assurer la stabilité glycémique en toute circonstance: jeûne, exercice physique, repas.Le glucagon joue effectivement un rôle essentiel dans la régulation du métabolisme du glucose par son action s’opposant à celle de l’insuline. Son site d’action est principalement hépatique. L’activité biologique du glucagon est médiée par sa fixation à un récepteur glycoprotéique membranaire, qui conduit à l’activation de l’adényl-cyclase, et ainsi à la conversion d’ATP en AMP cyclique, qui joue le rôle de deuxième messager. L’action du glucagon stimule la production hépatique de glucose, et maintient de cette façon un apport glucosé suffisant à l’organisme lors du jeûne ou durant un exercice physique prolongé. La baisse de la glycémie dans ces circonstances détermine la libération du glucagon par l’intermédiaire du système nerveux autonome dès que la menace de carence glucosée cérébrale est perçue au niveau central. À l’inverse, la prise glucidique orale freine la sécrétion du glucagon, tant par l’ascension glycémique et insulinémique que par le jeu inhibiteur de l’axe entéro-insulaire.La production hépatique du glucose entretenue par le glucagon est médiée par une protéine kinase AMP cyclique dépendante. Celle-ci favorise la glycogénolyse et la glycolyse par phosphorylation enzymatique ainsi que la mise en jeu de la néoglucogenèse à partir des lipides. L’oxydation des acides gras est accompagnée d’une augmentation de la cétogenèse. Les corps cétoniques peuvent être utilisés par le cerveau lors du jeûne prolongé, épargnant ainsi les protéines qui seraient utilisées pour la glucoformation en leur absence. Bien que l’action principale du glucagon soit antagoniste de celle de l’insuline par son effet hyperglycémiant, le glucagon stimule la libération d’insuline par les cellules B. Il stimule également la libération de somatostatine par les cellules D.La somatostatineIdentifiée initialement en 1972 par Guillemin et Brazeau au niveau hypothalamique, ce peptide de quatorze acides aminés est également sécrété par le cellules D des îlots et par les cellules endocrines de la région antro-duodénale du tube digestif. Son action semble complexe au niveau pancréatique, à la fois paracrine, endocrine et neurocrine. Ses effets sont essentiellement inhibiteurs de la sécrétion des cellules A, B et F, mais également des sécrétions gastriques, intestinales, biliaires et pancréatiques exocrines.Le polypeptide pancréatiqueLe polypeptide pancréatique synthétisé par les rares cellules F des îlots de Langerhans reste d’action mal définie. Ses effets physiologiques pourraient être nuls pour certains auteurs. Sa valeur pratique est essentiellement celle d’un marqueur des tumeurs endocrines pancréatiques, soit circulant, soit in situ, étant donné son fréquent repérage dans ce contexte.Maladies du pancréas endocrineLe diabète sucré et les tumeurs endocrines du pancréas constituent la pathologie essentielle des îlots de Langerhans.Le diabète sucré . Le déficit absolu ou relatif de la sécrétion d’insuline par les cellules B caractérise le diabète sucré quelle qu’en soit sa forme clinique [cf. DIABÈTE].Les tumeurs endocrines du pancréas . Bien que rares (moins de 0,5 p. 100 des tumeurs pancréatiques), les tumeurs endocrines attirent l’attention par leurs particularités physiopathologiques, histologiques, cliniques et évolutives. Elles sont dénommées par leur principal produit de sécrétion suivi du suffixe -ome . Les insulinomes représentent 75 p. 100 d’entre elles et les gastrinomes (syndrome de Zollinger-Ellison) 25 p. 100, les autres formes étant rarissimes. Leur caractère mixte est, en fait, assez fréquent depuis qu’il est identifiable par le progrès de l’immunohistochimie, capable de repérer in situ la présence des différentes hormones pancréatiques ou d’autres produits hormonaux. Leur développement est lent, même pour les formes malignes, s’étendant sur plusieurs dizaines d’années parfois. La distinction entre tumeur bénigne et tumeur maligne est souvent difficile à l’examen anatomopathologique de la pièce opératoire, et c’est souvent sur la présence de métastases hépatiques qu’est posé le critère de malignité. Sur le plan clinique, leur repérage est plus ou moins précoce selon l’expression variable du syndrome endocrinien et leur localisation souvent difficile malgré les progrès de la chirurgie et de l’imagerie médicale. La sensibilité originale mais variable des formes malignes à certaines chimiothérapies (streptozotocine, DTIC, 5 fluoro-uracile) et l’efficacité inconstante des analogues pharmacologiques de la somatostatine peuvent permettre des survies prolongées, même à des stades évolués.InsulinomesLe diagnostic des insulinomes repose sur la mise en évidence d’une sécrétion insulinique excessive non suppressible par l’hypoglycémie. Les symptômes révélateurs principaux comprennent la survenue répétée de malaises hypoglycémiques graves survenant à jeun ou à l’effort et la prise simultanée de poids.La mesure de la glycémie et de l’insulinémie lors d’un épisode symptomatique est essentielle car elle atteste de l’origine hypoglycémique et d’un rapport insulinémie/glycémie anormalement élevé. La mesure contemporaine des hormones de la contre-régulation glycémique (glucagon, hormone de croissance, cortisol) permet d’éliminer surtout une étiologie organique par insuffisance surrénale ou hypophysaire. L’absence de malaise spontané fait recourir à l’épreuve de jeûne, éventuellement sensibilisée par la pratique d’un exercice physique, pour les déclencher. Sa valeur diagnostique est élevée.Le diagnostic de localisation de la lésion pancréatique insulinosécrétrice est beaucoup plus difficile. Les explorations morphologiques non invasives (échographie, tomodensitométrie, imagerie par résonance magnétique) sont rarement positives, sauf dans les formes malignes avec métastases hépatiques. L’artériographie cœlio-mésentérique et les prélèvements veineux par cathétérisme portal à la recherche de la source de l’hyperinsulinisme sont plus sensibles mais complexes dans leurs réalisation et interprétation. Souvent, encore, c’est la laparotomie exploratrice avec palpation minutieuse du pancréas après son décollement, parfois guidée par une échographie, voire des prélèvements in situ peropératoires, qui conduit au diagnostic topographique. L’énucléation de la lésion est rarement possible, indiquant la pratique d’une pancréatectomie corporéo-caudale ou d’une duodéno-pancréatectomie céphalique selon la localisation; plus rarement, une embolisation vasculaire est pratiquée. Les insulinomes sont généralement bénins (plus de 80 p. 100 des cas), mais la différenciation entre bénin et malin est difficile sur le plan anatomo-pathologique en l’absence de métastases. Une surveillance à distance de toute exérèse est donc préférable, même si la bénignité est vraisemblable. La possibilité d’intégration de l’adénome pancréatique dans le cadre d’une polyadénomatose endocrinienne de type I (NEM I) rend utile la recherche d’une hyperparathyroïdie, d’un adénome hypophysaire ou thyroïdien.Syndrome de Zollinger-EllisonVenant en seconde position pour la fréquence, les tumeurs endocrines du pancréas sécrétant de la gastrine, responsables du syndrome de Zollinger-Ellison, sont des tumeurs dites paracrines et ectopiques . La gastrine est effectivement sécrétée physiologiquement par les cellules G de l’antre gastrique et ne l’est pas par les îlots de Langerhans. La symptomatologie clinique révélatrice typique comprend deux types de manifestations digestives: des ulcérations gastriques et/ou intestinales volontiers multiples et récidivantes et une diarrhée. Le diagnostic est posé sur la mise en évidence d’une hypergastrinémie et d’une sécrétion acide gastrique basale anormalement élevée et majorée par la sécrétine, repérée par la mesure du débit acide basal et stimulé à partir du recueil de la sécrétion gastrique par tubage. Le repérage de la tumeur, souvent multifocale, est difficile, et repose sur les mêmes explorations préopératoires que pour l’insulinome. Le gastrinome pancréatique est souvent malin (60-70 p. 100 des cas), mais la chimiothérapie à base de streptozotocine donne de fréquentes réponses positives.Autres tumeurs endocrines du pancréasIl s’agit de tumeurs rarissimes responsables d’une ou de plusieurs sécrétions hormonales, orthocrines ou paracrines, parfois non sécrétantes. Leur malignité est fréquente et grève le pronostic. L’efficacité de la streptozotocine est inconstante, mais l’usage récent des analogues de la somatostatine a permis de constater des améliorations chez de nombreux patients sur le plan symptomatique. Le glucagonome est caractérisé par une lésion cutanée spécifique et grave présente dans 70 à 90 p. 100 des cas, l’érythème nécrolytique migrateur, et une altération rapide de l’état général. Il s’y associe un diabète souvent modéré malgré l’hyperglucagonémie marquée. Sa malignité fréquente et son évolution infiltrante et métastatique de mauvais pronostic sont tempérées par une évolution lente qui rend une exérèse même partielle souvent bénéfique. Le choléra pancréatique , ou syndrome de Verner-Morrisson, est marqué par une diarrhée hydroélectrolytique majeure altérant rapidement l’état général. Il est dû à une hypersécrétion de VIP (polypeptide vaso-intestinal) souvent accompagnée d’autres sécrétions hormonales. Les somatostatinomes , les tumeurs endocrines responsables de sécrétions ectopiques avec syndrome de Cushing (ACTH), acromégalie (GHRH) ou hyperparathyroïdie (PTH) associés; les PPomes sécrétant le polypeptide pancréatique sont exceptionnels, souvent multisécrétants (tumeurs mixtes) et malins. L’hyperplasie endocrine du pancréas , dont la nésidioblastose néonatale est la forme la plus connue, est liée à une prolifération diffuse des îlots dont l’expression endocrine est de nature et d’intensité variables, l’évolutivité lente et la thérapeutique controversée.
pancréas [ pɑ̃kreas ] n. m. ♦ Glande annexe du tube digestif, de forme allongée, située derrière l'estomac, entre la deuxième portion du duodénum et la rate. Sécrétion externe du pancréas : le suc pancréatique. Sécrétion interne (hormonale) du pancréas (insuline et glucagon). ⇒ îlot (de Langerhans). Ablation du pancréas (PANCRÉATECTOMIE n. f. ).
● pancréas nom masculin (grec pagkreas, de pan, tout, et kreas, chair) Organe glandulaire situé dans l'abdomen, au-dessous et en arrière de l'estomac, qui sécrète le suc pancréatique (déversé dans l'intestin pour servir à la digestion) ainsi que deux hormones, l'insuline et le glucagon, excrétées dans le sang pour la régulation du métabolisme du glucose. ● pancréas (expressions) nom masculin (grec pagkreas, de pan, tout, et kreas, chair) Cancer du pancréas, tumeur maligne se développant aux dépens du pancréas exocrine (c'est-à-dire du tissu glandulaire sécrétant les enzymes digestives), le plus souvent sous la forme d'un adénocarcinome (cancer du tissu glandulaire), beaucoup plus rarement aux dépens du pancréas endocrine (c'est-à-dire du tissu glandulaire sécrétant l'insuline), sous la forme d'un insulinome.pancréasn. m. Glande abdominale, endocrine et exocrine, située derrière l'estomac qui sécrète d'une part le suc pancréatique (qui contient des enzymes digestives) d'autre part des hormones (le glucagon et l'insuline).⇒PANCRÉAS, subst. masc.ANAT. Glande allongée, annexée au tube digestif, située chez l'homme contre le rachis, derrière l'estomac, communiquant avec le duodénum par des canaux excréteurs et ayant une sécrétion mixte, endocrine (production d'insuline) et exocrine (production du suc pancréatique). Tête, corps, queue du pancréas; calcul, tumeur (kyste, cancer) du pancréas. Il eut l'impression que les tripes, le foie, la rate et le pancréas lui tombaient pêle-mêle dans le bas-ventre (COURTELINE, Ronds-de-cuir, 1893, 6e tabl., 2, p.229). Les ferments qu'elles [les membranes digestives] sécrètent collaborent avec ceux du pancréas pour transformer les aliments en substances absorbables par les cellules de l'intestin (CARREL, L'Homme, 1935, p.79). V. adrénaline ex. 2.— P.méton., CHIR., MÉD. Maladies du pancréas. Le matin, il avait son service à la Charité, chez le professeur Bourdeley, celui du pancréas (ARAGON, Beaux quart., 1936, p.200).REM. 1. Pancréatectomie, subst. fém., chir. Ablation totale ou partielle du pancréas. La greffe sous-cutanée du pancréas peut empêcher la glycosurie en cas de pancréatectomie totale (LE GENDRE ds Nouv. Traité Méd. fasc. 7 1924, p.446). 2. Pancréatisé, -ée, adj., physiol. Qui a été soumis à l'action chimique du pancréas. Aliments salivés, gastriqués, bilés, pancréatisés (Cl. BERNARD, Notes, 1860, p.41).Prononc. et Orth.:[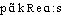 ], [-eas]. DG, Lar. Lang. fr. [a] mais Pt ROB. et WARN. 1968 [
], [-eas]. DG, Lar. Lang. fr. [a] mais Pt ROB. et WARN. 1968 [ ]. Att.ds Ac. dep. 1762. Étymol. et Hist. 1562 (A. PARÉ, Premier Livre de l'Anatomie, 17, éd. J.-F. Malgaigne, I, p.142b). Empr. au gr.
]. Att.ds Ac. dep. 1762. Étymol. et Hist. 1562 (A. PARÉ, Premier Livre de l'Anatomie, 17, éd. J.-F. Malgaigne, I, p.142b). Empr. au gr.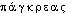 comp. de
comp. de 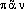 , neutre de
, neutre de 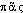 «tout» et
«tout» et 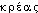 «chair» (ainsi nommé parce qu'il ressemble à un morceau de chair). Fréq. abs. littér.: 109.pancréas [pɑ̃kʀeas] n. m.❖♦ Anat., cour. Glande annexe du tube digestif, de forme allongée, située derrière l'estomac, entre la deuxième portion du duodénum et la rate. || Tête, corps, queue, col ou isthme du pancréas. || Le pancréas se comportant comme une glande exocrine, sécrète le suc pancréatique (⇒ Trypsine), et comme une glande endocrine, l'insuline.❖DÉR. Pancréatine, pancréatique, pancréatite.COMP. Pancréatectomie.
«chair» (ainsi nommé parce qu'il ressemble à un morceau de chair). Fréq. abs. littér.: 109.pancréas [pɑ̃kʀeas] n. m.❖♦ Anat., cour. Glande annexe du tube digestif, de forme allongée, située derrière l'estomac, entre la deuxième portion du duodénum et la rate. || Tête, corps, queue, col ou isthme du pancréas. || Le pancréas se comportant comme une glande exocrine, sécrète le suc pancréatique (⇒ Trypsine), et comme une glande endocrine, l'insuline.❖DÉR. Pancréatine, pancréatique, pancréatite.COMP. Pancréatectomie.
Encyclopédie Universelle. 2012.
